| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 |
- 영작 연습
- TCF
- 동물들 속이기
- 누에섬 가는길
- 영어 첫문자
- 의료기기 사후 관리
- psur이란?
- ㅖㅡㅊㄹ
- psur에 들어가는 항목들
- 갯뻘 체험
- 영어 이메일 작성 방법
- mdcg 2020-7
- 연애
- 웃긴 사진
- emdn
- 연애 유머
- mdr 변경
- psur 정리
- 땀띠란
- 영어로 어떻게?
- rltnfanst
- 고급스러운 영어
- 2024 장마 시기
- 장마 시기
- 장마 언제
- 부드러운 영어
- mdr 전환
- mdcg
- 탄도항
- 땀띠 해결
- 연애 초창기
- 절차서
- 웃긴 사진들
- 도심 계곡
- 한강 뷰
- 갯뻘체험
- 의료기기 임상
- 재밌는
- 2024 장마철
- mdcg 2020-
- ㅔ녁
- 도심 힐링
- mdcg 2022-21
- 품질 시스템
- PMCF
- PMCF STUDY
- MDR
- 학교 연애
- mdr tcf
- 사내 연애
- 웃긴 자료
- 우이동 계곡
- 잠수교 야경
- 여름철 별
- 의료기기 사후조치
- 웃긴 동물 사진
- 땀띠 원인
- 품질 매뉴얼
- mdr 기술문서
- 탄도 전망대
- 영어 이메일
- 영어 첫문장
- 여름청
- PMCF PLAN
- ㅡㅇㄱ
- 귀여운 동물들
- 안산
- Post Market Clinical Follow up
- 잔여 위험
- 비지니스 영어
- emdn 코드
- 6월 무더위
- 대학 연애
- psur 번역
- 땀띠 없애기ㅏ
- 계절병
- 임상후속조치
- 영작하는 방법
- PMCF STUDY 방법
- 땀띠 어떻게
- ㅖㅣㅊㄹ ㅔㅣ무
- 하루 영단어
- 바다 갈라짐
- emdn code
- 잠수교 가는법
- PMCF STUDY 분석 방법
- 경기도 야경
- 2024 무더위
- iso 13485
- CE MDR
- psur psur이 대체 뭘까? psur의 모든 것! psur 개념 소개글 입니다.
- psur
- #하루 영단어 고급스러운 영어 #영작하는 방법 #영어 이메일 #부드러운 영어 #왕초보 영어
- 2024 장마
- CND CODE
- 의료기기
- 웃긴
- 안산 가볼만한 곳
- psur의 모든 것
- CE
녹차입니다. Greeting, here is Green-tea
CE MDR과 연관된 임상평가 4탄 본문
CE MDR과 연관된 임상평가 4탄
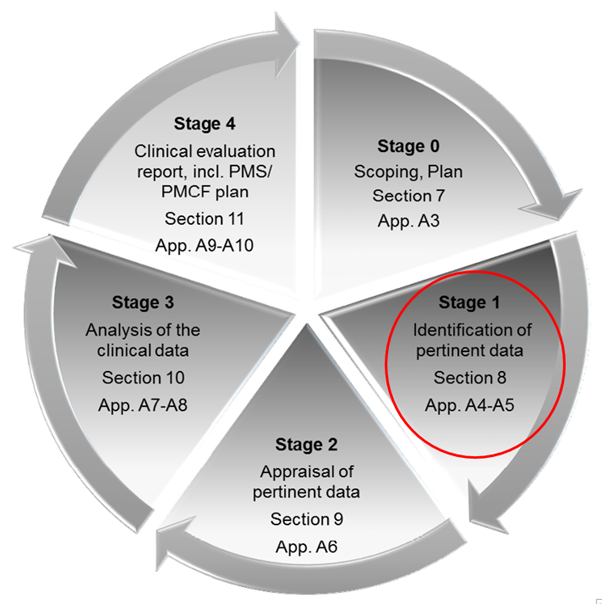
[5.1] 0 단계: 적용범위, 임상평가 계획에는 다음과 같은 사항이 포함되어야 합니다.
평가 대상 기기에 대한 설명서와 임상평가 계획서를 준비하고 임상평가 전에 임상평가 계획서에 Essential Requirement과 GSPR을 기반으로 한 의료기기의 Scope를 정의해야 하고, 의료기기의 역사적 사실을 기술해야 하며 최신 지식의 기술 포함, 자 여기서 최신 지식의 기술이란 어떤 것을 의미 할까요? (state of art) 이 부분은 최신기술이 가장 최근까지의 어떠한 임상적 자료가 있는지를 꼭 확인하라는 의미 예를 들어 부작용 사례 등이 있다.
그리고 또 한가지 목적은 의료기기는 항상 리스크가 존재하기에 기존 기술과의 비교를 통해 기존기술보다 이득이 더 큰지를 결정하기 위함이다.
계획서에는 기기의 일반적인 설명을 한다. 또한 하기 [표1]과 같이 CE 마크 전과 후를 참조하여 해당되는 부분으로 작성하여 계획서에 첨부한다. 임상 평가는 비판적이어야 하며 긍정적인 자료와 부정적인 자료 모두를 확인, 평가 및 분석할 필요가 있다.
예를 들어서 부정적인 자료로는 임상 결과로써 부작용이나 환자의 심각한 위험이 있을 수 있고, 긍정적인 자료는 임상 결과에 따른 환자 삶의 질의 향상 등이 있을 수 있다.
임상 팀은 긍정적인 임상 결과 중 환자 삶의 질 향상은 PMCF 보고서를 통해 주기적인 관리를 한다.
고려사항
CE 마크 전
의료기기
CE 마크 승인
의료기기
기기 설명
●
●
특별한 주의가 요구되는 의료기기의 설계 특징, 또는 지침 또는 대상군이 존재하는지의 여부. 임상평가는 특수 성능 또는 안전성 관련 우려사항 (예, 의료적, 인간 또는 동물 구성성분의 존재), 의료기기의 의도된 목적 및 적용 (예, 치료 대상군 및 질병, 제안된 경고, 금기증, 예방책, 적용 방법) 그리고 의료기기의 임상 성능 및 임상 안전성에 대한 제조자의 특정 선전문구를 내포하는 모든 설계 특징을 포함해야 한다.
●
●
동등성 주장의 가능성이 있는 경우, 동등성 평가를 위해 필요한 정보
의료기기의 위험경영 문서, 예, 위해 요인 규명 목록, 위험 분석에서 규명된 임상적 위해. 임상평가의 적용범위에는 당사의 위험경영 문서를 위한 교차 인용규격 및 인용규격으로부터의 자료가 필요하다. 위험경영 문서는 이를 기반으로 의료기기와 관련된 위해를 확인하고 그러한 위해를 어떻게 다루어야 하는지 알 수 있어야 한다. 임상평가는 당사가 설계 위험 완화 전략을 적용한 후에도 남아있는 모든 임상적 위해의 중요성에 대해 다루어야 한다.
해당 의료 분야의 최근 지식, 최신 기술, 예, 적용 가능한 규격 및 지침 문서, 의료기기로 관리하는 의학적 병태 및 병태의 자연스러운 진행과정과 관련된 정보, 벤치마크 기기, 기타 기기 및 대상군에 이용 가능한 의료적 대안
오늘의 포스팅은 여기까지이며 향후 포스팅에서는 임상평가 2단계부터 시작 하겟습니다.
읽어주셔서 감사합니다.
'MEDICAL DEVICE > CLINICAL EVALUATION 임상평가' 카테고리의 다른 글
| CE MDR과 연관된 임상평가 6탄 (7) | 2021.02.20 |
|---|---|
| CE MDR과 연관된 임상평가 5탄 (4) | 2021.02.19 |
| CE MDR과 연관된 임상평가 3탄 (11) | 2021.02.18 |
| CE MDR과 연관된 임상평가 2탄 맛보기~ (13) | 2021.02.17 |
| PMCF 6-1탄! PMCF evaluation Report에는 어떤 내용이 들어갈까? (10) | 2021.02.06 |

